Disparition catastrophique des abeilles et des insectes dûe aux cendres volantes de charbon de la géo-ingénierie
Traduction : Association Ciel voilé
Asian Journal of Biology

6(4): 1-13, 2018; Article no.AJOB.43268
ISSN: 2456-7124
______________________________________________________________________________________________
FACTEURS POTENTIELS PRÉCÉDEMMENT NON RECONNUS DANS
LA DISPARITION CATASTROPHIQUE DES ABEILLES ET DES INSECTES
RÉSULTANT DE LA GÉO-INGÉNIERIE PAR CENDRES VOLANTES DE CHARBON
Mark Whiteside and J. Marvin Herndon
Contributions des auteurs
Ce travail découle d’un effort conjoint entre les auteurs dans le cadre d'une collaboration continue visant à fournir des données scientifiques, médicales, et de santé publique, ainsi que des preuves liées aux pulvérisations de cendres volantes de charbon en aérosol utilisées par une géo-ingénierie secrète quasi journalière et quasi mondiale. L’auteur MW est principalement responsable des données entomologiques. L'auteur JMH est le principal responsable pour les considérations minéralogiques et géophysiques. Les deux auteurs ont lu et approuvé le manuscrit final.
Information sur l’article
DOI: 10.9734/AJOB/2018/43268
Editeur(s):
-
Paola Angelini, Département de Chimie, Biologie et Biotechnologie, Université de Pérouse, Pérouse, Italie.
(2) P. Dhasarathan, Département de Biotechnologie, Prathyusha Engineering College, Anna University, Inde.
Réviseurs:
-
Manoel Fernando, Federal University of Grande Dourados, Brésil.
-
Yahya Ahmed Shaban Al Naggar, Tanta University, Egypte.
-
Sainudeen Pattazhy, S.N.College, University of Kerala, Inde.
-
S. Basavarajappa, University of Mysore, Inde
Historique complet de l'évaluation par les pairs : http://www.sciencedomain.org/review-history/25994
Article de recherche inédit
Received 13th June 2018
Accepted 13th June 2018
Published 25th August 2018
SOMMAIRE
Objectifs : Nous avons précédemment étudié des facteurs potentiellement importants jusqu'à lors non reconnus dans la mortalité mondiale des abeilles et des insectes, résultant des pulvérisations de cendres volantes de charbon (CVC) en aérosol pour la manipulation secrète du climat et des conditions météorologiques. Nous présentons également des preuves légales selon lesquelles les CVC sont la principale matière utilisée dans les opérations de géo-ingénierie par pulvérisations atmosphériques.
Méthodes : Nous avons mené des recherches approfondies dans la littérature et utilisé en outre la spectrométrie de masse à plasma à couplage inductif.
Résultats : Les principaux composants des CVC, silicium, aluminium et fer, constitués en partie de magnétite (Fe3O4), présentent tous une toxicité potentielle importante pour les insectes. Bon nombre d’oligo-éléments présents dans les CVC sont nocifs pour les insectes ; nombre d'entre eux (par exemple l'arsenic, le mercure et le cadmium) sont utilisés en tant qu’insecticides. Les particules toxiques et les métaux lourds présents dans les CVC contaminent l'air, l'eau et le sol et ont donc un impact sur toute la biosphère. Il a été démontré que les composants des CVC, y compris l'aluminium extractible sous une forme chimiquement mobile, sont nocifs pour les insectes dans les environnements terrestre, aquatique et aérien. Les éléments primaires et les oligo-éléments provenant des CVC ont été trouvés sur, dans et autour des insectes et des plantes dont ils se nourrissent dans les régions polluées du monde entier. La magnétite des CVC peut potentiellement perturber la réception magnétique des insectes. Le chlore et certains autres constituants des CVC pulvérisés en aérosol peuvent détruire l'ozone atmosphérique, exposant ainsi les insectes à des degrés élevés de mutagénèse et des niveaux létaux du rayonnement solaire UV-B et UV-C.
Conclusions : Il est nécessaire de dénoncer et d’arrêter la géo-ingénierie par aérosols atmosphériques afin d’empêcher une contamination plus importante de la biosphère. Au fur et à mesure que les populations d'insectes diminueront, les populations d'oiseaux diminueront également, ainsi que les populations animales et les populations humaines. Le retour progressif des insectes suite à l'arrêt des pulvérisations aériennes sera la meilleure preuve que les CVC pulvérisées en aérosol sont en fait l’une des principales causes du déclin inexorable actuel de la population et de la diversité des insectes.
Mots-clés: dépérissement d'insectes; biodiversité; géo-ingénierie; cendres volantes de charbon; toxicité de l'aluminium; effondrement des colonies; magnétite.
-
INTRODUCTION
Le public est sensibilisé et préoccupé [1] par le déclin de la population de l'abeille domestique occidentale, Apis mellifera, le principal pollinisateur agricole au monde [2]. Les populations de bourdons (Bombus sp.), pollinisateurs secondaires mais néanmoins importants, sont également en déclin en Amérique du Nord et en Europe [3-5]. Evans et al. [6] ont étudié 61 variables quantifiées, telles que les niveaux de pesticides et les charges d'agents pathogènes chez l’Apis mellifera et ont rapporté : « Aucune mesure n'apparaît comme étant la cause probable responsable de l’effondrement des colonies ». Comme l'a noté Watanabe [7], « Il n'y a pas de preuve irréfutable ».
Une étude récente a documenté le déclin alarmant, une réduction de 75% des populations d'insectes (biomasse) dans les aires protégées allemandes au cours des trois dernières décennies [8]. Cette perte spectaculaire de l’abondance et de la diversité des insectes a de profondes répercussions sur le réseau trophique mondial et les écosystèmes. Dans cette étude, ni le changement climatique ni l’utilisation des terres ne pouvaient être liés à cette diminution effrayante des insectes, bien que les pratiques agricoles et l’utilisation des pesticides ne puissent pas être exclues comme facteurs contributifs. Tout comme pour le déclin des abeilles mellifères occidentales, il n’existe pas de cause facilement identifiable, pas de «preuve irréfutable».
Des déclins de biodiversité ont été signalés ailleurs dans d'autres espèces. Par exemple, Brooks et al. [9] au Royaume-Uni ont rapporté sur une période de 15 ans que les trois quarts des espèces de carabes étudiées avaient considérablement diminué. Des déclins similaires ont été signalés pour les macro-papillons communs [10] et les papillons britanniques [11]. Au cours des 40 dernières années, il y a eu un déclin de 45% des invertébrés, un déclin qui comprend tous les principaux ordres d'insectes [12]. Aucune cause identifiable de ces déclins n'a été identifiée.
Ces études mettent clairement en évidence une cause à grande échelle de la disparition des insectes et soulignent un besoin urgent de découvrir la ou les causes sous-jacentes réelles de ce déclin d'insectes. Toutefois, il est fort probable que les cendres volantes de charbon (CVC) délibérément pulvérisées en aérosols, un sous-produit toxique et mondial de la combustion du charbon, contribuent potentiellement et grandement à la disparition mondiale des insectes.
Lorsque le charbon est brûlé, principalement dans les centrales à charbon qui produisent de l'électricité, les cendres lourdes se déposent, tandis que les cendres légères, formées dans les gaz au-dessus du brûleur, sortiraient des cheminées si elles n'étaient pas piégées et enfermées tel que les règlementations modernes l'exigent. Les cendres volantes sont l'un des plus importants flux de déchets industriels au monde. L'élimination des CVC est problématique; elles sont souvent simplement déversées dans des bassins de surface ou placées dans des décharges, ce qui pose des problèmes de contamination des eaux souterraines et de pollution de l'environnement [13,14]. Cependant, dans de nombreux pays, y compris les États-Unis, un pourcentage important des cendres volantes de charbon est recyclé en matériau de construction et en produits tels que le béton [15]. Les cendres volantes du charbon sont également utilisées dans les additifs pour le sol et les engrais [16].
Des rapports disponibles montrent que les CVC sont utilisées comme matériau de base pour les pulvérisations par avions des opérations secrètes de manipulation du climat (Fig. 1) [17,18]. Les CVC sont constituées de particules dont la largeur varie de moins de 0,1 µm à 50 µm et nécessitent donc peu de traitement supplémentaire pour être utilisées comme aérosols pour altérer le climat. Pulvérisées dans l'atmosphère, ces particules réfléchissent un peu la lumière du soleil, mais elles absorbent également l'énergie qui est transférée dans l'atmosphère par collision moléculaire. Les particules bloquent également la chaleur qui quitte la surface de la Terre. Les particules en aérosol bloquent les précipitations en empêchant les gouttelettes d’eau de s’assembler et de tomber sous forme de pluie. L'effet est de provoquer la sécheresse, mais finalement, l'atmosphère devient tellement chargée d'humidité que des tempêtes se produisent avec des pluies diluviennes. Ces pulvérisations aériennes secrètes aggravent le réchauffement climatique et perturbent intégralement les conditions météorologiques naturelles [19].

Fig. 1. Traînées de particules pulvérisées par avion pour manipuler les conditions météorologiques. (Photographes avec autorisation) Dans le sens des aiguilles d'une montre en partant du coin supérieur gauche: Karnak, Egypte(auteur JMH); Londres (Angleterre) (Ian Baldwin); Genève, Suisse (Beatrice Wright); Chattanooga, TN, États-Unis (David Tulis); San Diego, Californie, États-Unis (auteur JMH); Jaipur, Inde (auteur JMH)
Dans le cadre de la présente enquête, des efforts sont déployés pour décrire et démontrer que les CVC sous forme d'aérosols produisent des éléments toxiques qui contaminent l'environnement et peuvent potentiellement contribuer de façon importante à la disparition des insectes. Ceci inclut en particulier, les conséquences des diffusions de toxines des CVC dans les eaux pluviales et les effets des composants particulaires des CVC sur la viabilité des insectes. En outre, nous discutons des conséquences néfastes d’une augmentation du rayonnement solaire UV-B et UV-C résultant simultanément de la réduction de l’ozone dans l’atmosphère du fait des pulvérisations en aérosols de CVC.
2. MÉTHODES
Face aux pulvérisations évidentes de particules dans l'air, il existe un effort concerté pour tromper le public et la communauté scientifique pour nier ces faits et leurs conséquences néfastes sur la santé humaine et environnementale [20]. Les CVC sont un matériau idéal pour leur utilisation dans des opérations de géo-ingénierie à l'échelle mondiale, pour les raisons suivantes : (1) Il s'agit d'un résidu industriel majeur; (2) Il est produit à la taille requise sans grand traitement supplémentaire; et (3) Les installations de sa production sont déjà en place, hors de vue et utilisent le transport ferroviaire.
Les méthodes pour démontrer que les particules pulvérisées en aérosols correspondent aux CVC sont doubles: (1) elles montrent que les quantités relatives d’éléments dissous dans l’eau de pluie sont similaires aux quantités d’éléments des CVC diluées dans l’eau lors des études de lixiviation en laboratoire [21]; et, (2) elles confirment que les quantités relatives d'éléments apportées par la neige, d'une manière analogue à la technique de co-précipitation [17], sont similaires aux quantités relatives d'éléments trouvés dans les CVC [21]. Les mesures précédemment publiées et présentées sont ici faites par spectrométrie de masse à plasma à couplage inductif.
-
RÉSULTATS ET DISCUSSION
Depuis au moins le début du 21ème siècle et même avant, de nombreux citoyens du monde entier sont témoins de pulvérisations aériennes formant des traînées de particules dans le ciel [22]. N’ayant aucune information fiable sur la composition chimique et les risques potentiels pour la santé de la substance pulvérisée en aérosols, des citoyens concernés ont prélevé des échantillons d'eau de pluie après pulvérisation et les ont envoyés à des laboratoires commerciaux pour les analyser. En règle générale, seule l'analyse de l'aluminium était demandée, parfois le baryum et le strontium également. Lorsque les pulvérisations aériennes sont devenues clairement une activité quasi quotidienne à San Diego (USA), l’un d’entre nous (JMH) a entamé une série d’études pour déterminer la composition des particules en aérosols. Le protocole courant pour des analyses d'eau certifiées en laboratoire nécessite une filtration pour éliminer les particules avant les mesures; par conséquent, l'eau de pluie avait assurément dissout ces trois éléments à partir de matières particulaires facilement lixiviables avant qu'elles ne tombent au sol.
En exprimant les données sous forme de ratios par rapport à un élément commun tel que le baryum, les conséquences des divers degrés de dilution sont éliminées. La comparaison entre ces résultats analytiques, exprimés en ratios par rapport au baryum, et les analyses expérimentales correspondantes de lixiviation des cendres volantes de charbon (CVC), a fourni la première preuve scientifique que les CVC sont la principale substance polluante utilisée par la géo-ingénierie troposphérique en cours [23].
Afin de comprendre le processus chimique en cause, prenons comme exemple hypothétique des feuilles de thé en poudre fine qui seraient pulvérisées dans la troposphère. L'humidité atmosphérique «infuserait» le thé, diluerait le tanin et d'autres produits chimiques qui tomberaient sous forme de pluie, avec la signature chimique du thé; la pluie serait du thé, très dilué. Les cendres volantes de charbon (CVC) se forment principalement par condensation dans les gaz de combustion chauds dans la cheminée située au-dessus de la chambre de combustion des centrales électriques au charbon, contrairement à celles généralement rencontrées dans la nature et consiste en un assemblage déséquilibré de matière typiquement anhydre [24]. L'eau est capable d'absorber rapidement de nombreux éléments toxiques des CVC [21]. Lorsque les CVC sont pulvérisées dans la troposphère, l'eau atmosphérique absorbe de nombreux éléments toxiques par lessivage, qui sont ensuite dissous dans l'eau de pluie et constituent une signature chimique des CVC. Plus il y a d'éléments mesurés dans l'eau de pluie, plus la signature devient précise et unique. C’est une signature significative car les sables et les sols sur lesquels souffle le vent ne sont pas facilement ni rapidement lessivés par l'eau de pluie.
La figure 2. compare des analyses d’eaux pluviales aux séries de données de lixiviation de CVC en laboratoire. À l'exception des données de Bangor, Maine (États-Unis), les autres données ont été publiées et sont reproduites avec autorisation [18]. La dilution est un facteur variable qui peut être compensé dans les comparaisons d'analyses en utilisant des ratios. Dans de nombreux cas, la dilution empêche les éléments les moins abondants situés sous les limites d’être détectés dans les laboratoires d'analyse commerciaux. Les données de Bangor, Maine (USA), illustrées à la Fig. 2, sont particulièrement importantes d’autant plus que le facteur de dilution était faible et que des analyses significatives d’oligo-éléments requises ont pu être déterminées.
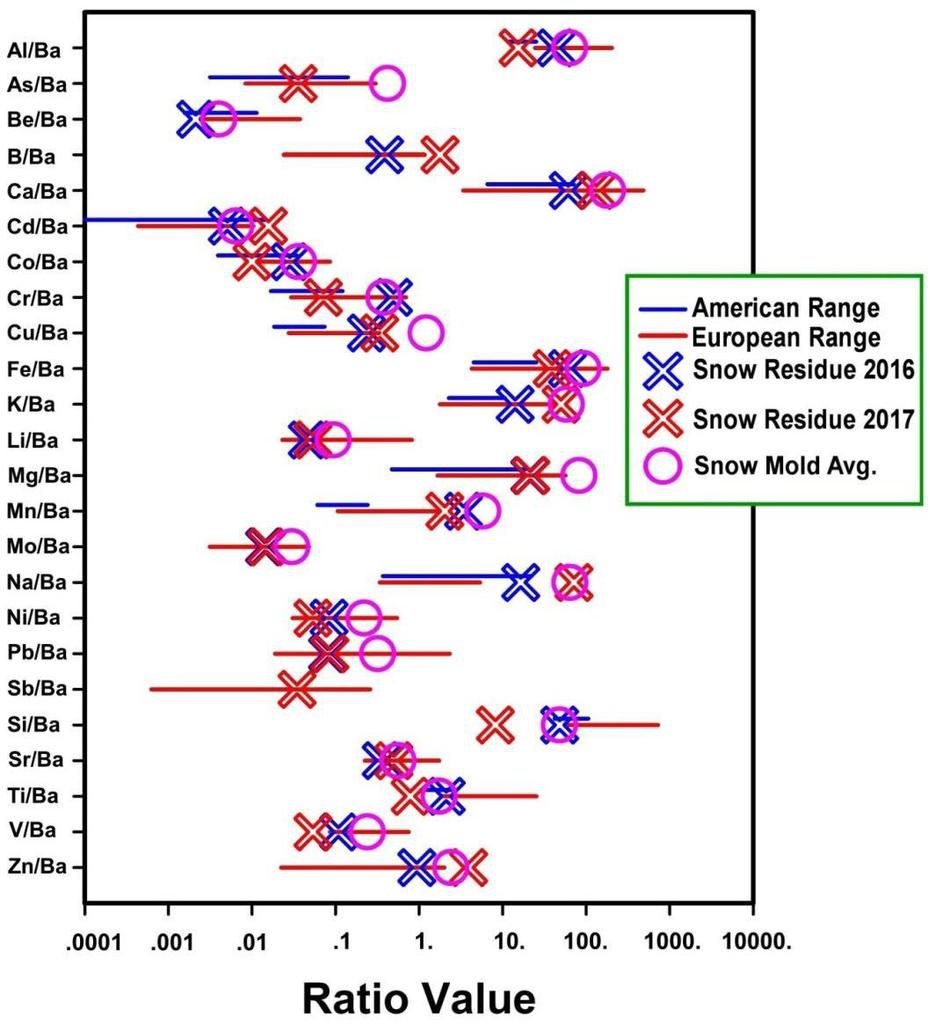
La figure 3, reproduite avec la permission de [18], montre des analyses de particules pulvérisées tombées avec la neige, le résidu par évaporation et le résidu piégé sur la moisissure sous-jacente lorsque la neige a fondu. Cette figure et la figure 2. montrent la gamme d'éléments toxiques qui contaminent l'environnement, étant donné que les CVC sont les principales particules utilisées pour la manipulation du climat.

Valeurs de ratios
Fig. 2. Ratios des éléments mesurés dans de l'eau de pluie et de neige filtrées après pulvérisations avec permission [18], et avec de nouvelles données sur l’eau de pluie à partir de 2011 à Bangor, Maine, USA, avec l’aimable autorisation de Russ Tanner
La composition de base des CVC est variable et dépend de la composition des charbons utilisés et de la dynamique du brûleur à charbon. Sur les figures 2 et 3, les gammes de compositions de base des CVC provenant d’échantillons de CVC européens sont indiquées par des lignes rouges, les gammes de compositions de base des CVC américaines sont signalées par des lignes bleues.
Les CVC en aérosol se mélangent à l'air que nous respirons et tombent sur la Terre, d'où la nécessité de pulvérisations quasi quotidiennes. Par conséquent, les CVC utilisées pour la
manipulation/l’intervention climatique contaminent lourdement la biosphère avec des CVC particulaires toxiques et des toxines des CVC diluées dans l'eau de pluie [17,18,22].
Les principaux éléments des CVC sont les oxydes de silicium, d’aluminium, de fer et de calcium, et des quantités moindres de magnésium, de soufre, de sodium et de potassium. Les principaux composants des CVC sont les aluminosilicates et une fraction du fer (magnétique) qui contient de la magnétite, Fe3O4. Les cendres volantes de charbon sont principalement composées de particules sphériques, également des sphérules d'aluminosilicate et de magnétite [24]. Les configurations sphériques sont dues à la tension superficielle des matières fondues lors de la condensation et de l'agglomération dans le gaz chaud au-dessus du brûleur à charbon [18]. Parmi les nombreux oligo-éléments présents à l'origine dans le charbon, présents dans les CVC, on peut citer l'arsenic (As), le baryum (Ba), le béryllium (Be), le cadmium (Cd), le chrome (Cr), le plomb (Pb), le manganèse (Mn), le mercure (Hg), le nickel (Ni), le phosphore (P), le sélénium (Se), le strontium (Sr), le thallium (Tl), le titane (Ti), le vanadium (V) et le zinc (Zn). De petites quantités de matière organique et même des radionucléides, l'uranium (U), le thorium (Th) et leurs isotopes radioactifs se trouvent dans les CVC [21,25].
Les premières études sur les effets néfastes de la pollution atmosphérique sur les insectes ont porté sur les émissions volatiles, notamment les gaz contenant du fluorure, du soufre (SO2), des oxydes d'azote et de l'ozone [26]. Il est maintenant reconnu qu'une exposition prolongée aux particules fines de la pollution atmosphérique est une cause majeure de morbidité et de mortalité dans le monde [27]. Les cendres volantes de charbon sont l'une des principales sources de pollution anthropique particulaire à l'échelle mondiale [28]. Les opérations de géo-ingénierie par aérosols troposphériques dont la portée et l’intensité ont augmenté ces dernières années, représentent une forme délibérée de pollution atmosphérique par particules fines générées par les cendres volantes de charbon qui contaminent également le sol et l’eau. Ce type de pollution particulaire peut affecter les insectes par la respiration, l'ingestion et le contact direct. Les particules présentes dans les CVC, dont les métaux et les métalloïdes, sont difficiles à éliminer par les organismes et sont toxiques pour les arthropodes à diverses concentrations et de manières différentes [29].
Valeurs de ratio
Fig. 3. Ratios d'éléments mesurés après pulvérisation dans les résidus de neige après évaporation, et dans la moisissure sous la neige fondante, de [18] avec permission
La pollution causée par les CVC peut affecter les insectes par le sol ( le bas) (par exemple par la qualité du sol ou de la plante hôte) ou par l'air (le haut) (par exemple, contact direct ou effets sur les prédateurs ou les agents pathogènes). Une revue complète a montré que la condition physique des insectes herbivores était généralement influencée par des facteurs ascendants. Des études moins poussées ont été effectuées sur les facteurs descendants, mais il a été démontré que la pollution de l'air affecte la dynamique des populations d'insectes par des effets différentiels sur les herbivores et leurs prédateurs naturels [30]. Les polluants s'accumulent souvent chez les insectes prédateurs. Les particules de pollution en suspension dans l'air recouvrent les feuilles et les plantes, affectant la chimie des plantes, la photosynthèse et, par conséquent, la nutrition des herbivores. La contamination du sol permet l'absorption par la plante de nombreux éléments qui sont à leur tour consommés par les herbivores [31]. Les cendres volantes de charbon ajoutées aux engrais ou au sol peuvent entraîner des accumulations d'éléments potentiellement toxiques, dont l'arsenic [32].
Les composants principaux des CVC, Si, Al et Fe ont tous des effets toxiques sur les insectes. Le dépôt de Si sur les tissus végétaux constitue une barrière contre le sondage, l'alimentation et la pénétration des insectes dans les tissus végétaux [33]. Les composants contenant du silicium enlèvent la couche cireuse des insectes qui préserve leur humidité, les tuant ainsi par déshydratation [34].
L'humidité peut diluer l'aluminium des CVC sous une forme chimiquement mobile [21]. L'aluminium ne se trouve généralement pas dans le monde naturel sous une forme chimiquement mobile, il y a donc une absence de mécanismes de défense; l'aluminium est un métal qui n’est pas essentiel et qui n’a aucune fonction biologique. L'aluminium se trouve dans les insecticides tels le phosphure d'aluminium, un matériau hautement toxique utilisé pour la conservation des graines. L'aluminium s'est révélé toxique (provoquant des déformations) chez les larves de phryganes, avec un effet accru en milieu acide [35].
Des études in vitro ont démontré la toxicité de l'aluminium chez la drosophile [36]. L'aluminium ingéré nuit au butinage et à d'autres comportements chez les abeilles [37].
Tout comme d'autres organismes, les insectes doivent équilibrer les propriétés opposées du fer ionique, celui d'un nutriment essentiel et d'une toxine puissante. Le fer doit être utilisé comme catalyseur du métabolisme oxydatif, mais il doit être étroitement régulé pour éviter les réactions oxydatives destructrices [38]. Le fer ionique est l'un des polluants atmosphériques les plus réactifs. Un effet biologique commun à de nombreuses particules de pollution de l'air ambiant est la perturbation de l'homéostasie du fer dans les cellules et les tissus [39]. Le fer est connu pour jouer un rôle catalytique dans la génération de radicaux libres d'oxygène in vitro. Des mouches domestiques buvant de l'eau additionnée de chlorure ferreux ont eu leur durée de vie raccourcie avec des signes de stress oxydatif [40]. Le fer s'accumule dans les insectes, provoquant une peroxydation lipidique et provoquant une réaction antioxydante [41].
Il existe actuellement des preuves plus directes des dommages causés par la pollution aux insectes, provenant des principaux composants des CVC. Exley et al. [42] ont rapporté que les bourdons pupae se trouvant dans les zones urbaines et rurales étaient fortement contaminés par l'aluminium. Cette teneur en aluminium était supérieure à celle considérée comme nocive pour l'homme et était associée à des bourdons pupae plus petits. Des niveaux élevés d'aluminium et d'autres éléments présents dans les cendres volantes de charbon (Cd, Co, Cr, Cu, Mn, Se, Sr, Ti et V) ont été mesurés chez les abeilles mellifères provenant de zones polluées [43,44]. Des niveaux élevés d'aluminium, de fer et de nombreux autres oligo-éléments, notamment As, Pb et Ba, ont été détectés dans le pollen d'abeille récolté dans des zones polluées [45-47]. Le pollen d’abeille est un mélange de pollen de fleur, de ses propres sécrétions et de nectar. On peut supposer que les abeilles absorbent une quantité importante de pollution par les métaux et les métalloïdes à partir d'un mécanisme «ascendant» par ingestion de produits végétaux et de sources d'eau potable contaminés. Dans le cas du pollen d’abeille, ce matériel est ramené à la ruche sur les pattes des insectes et constitue l’une de leurs principales sources de nutrition [45].
Outre les abeilles, d’autres insectes font figure de bio-indicateurs de la pollution par les métaux lourds, y compris les oligo-éléments présents dans les CVC. Au Pakistan, des concentrations significatives de Cd, Cu, Cr, Zn et Ni ont été détectées dans la libellule libellulid, dans une sauterelle acridienne et un papillon nymphalide. Les plus hauts niveaux de ces éléments ont été trouvés près des zones industrielles polluées et les valeurs les plus basses (mais toujours présentes) sur un site éloigné de l'activité industrielle [48]. L'accumulation de Cd, Co, Cu, Fe, Mn, Ni et Pb a été documentée chez des sauterelles (Orthoptera, Acrididae) qui ont été prises près d'une mine de cuivre en Bulgarie. Le cadmium et le plomb étaient fortement concentrés dans les sauterelles sur les sites les plus contaminés [49]. Des concentrations de Pb> Cd> Hg ont été trouvées dans des plantes alimentaires et des sauterelles prélevées dans une prairie de montagne à 1200 m au-dessus du niveau de la mer en Grèce, suggérant une source anthropique de pollution dispersée dans l'atmosphère [50].
En tant que bio-indicateurs de la pollution, les abeilles sont également utilisées comme échantillonneurs de particules en suspension dans l'air. Tel que rapporté par Negri et al. [51], les abeilles butinant dans les zones polluées recueillent de nombreuses particules de pollution inorganiques, principalement concentrées dans les ailes antérieures, la région de la tête et les pattes arrière. Ces particules anthropiques, dont le diamètre varie de 500 nm à 10 µm, présentent une morphologie « sous-sphérique » et ont été caractérisées par l'EDX comme étant des particules riches en Fe ou des aluminosilicates. Le plomb et le baryum (tous deux présents dans les CVC) ont également été détectés sur le corps de l'abeille [51].
Les cendres volantes de charbon sont une source considérable d’une pollution de taille nanoparticulaire. Les nanoparticules et bio-nanoparticules sont de plus en plus étudiées et utilisées pour lutter contre les insectes. Des nanoparticules d'aluminium, de silicium, de zinc et de titane (tous des composants des CVC) sont en cours de développement pour lutter contre les ravageurs des cultures [52]. Par exemple, la poussière de nanoparticules d’alumine peut être modifiée par synthèse pour cibler différentes espèces d’insectes [53]. Le nano-fer fabriqué chimiquement est en cours de développement en tant que pesticide efficace. Il a été démontré que les nanoparticules de fer et d'oxyde de fer sont hautement toxiques pour le Culex quinquefasciatus, le moustique de la région australe [54].
Récemment, une pollution aux nanoparticules sphériques de magnétite, les mêmes que celles des CVC, et différentes des particules de magnétite biogéniques, ont été trouvées en abondance dans les tissus cérébraux des humains atteints de démence [55]. De nombreux insectes (par exemple les abeilles, les fourmis, les termites) renferment de la magnétite biogénique et l'utilisent pour la magnéto réception [56-58]. Par exemple, les abeilles mellifères utilisent des granules de fer magnéto récepteurs situés dans leur abdomen tel un aimant de magnétite pour détecter le champ magnétique de la Terre [57]. Il est donc probable que des particules de pollution magnétiques exogènes puissent perturber ces fonctions.
Les mesures magnétiques de la poussière atmosphérique déposée constituent un paramètre supplémentaire pour évaluer la pollution de l'environnement. Des échantillons de cette pollution atmosphérique particulaire contiennent de la magnétite ayant une forme sphérique, similaires aux particules de la fraction magnétique des cendres volantes de charbon [59]. Les particules de magnétite biogènes et exogènes sont connues pour être extrêmement sensibles aux champs électromagnétiques externes [60]. Les insectes sont continuellement exposés aux champs électromagnétiques, radioélectriques ayant des fréquences différentes. La gamme de fréquences utilisées dans les systèmes de communication sans fil augmentera bientôt de 6 GHz à 120 GHz (5G). Il est à présent avéré que les insectes absorbent l’énergie électromagnétique des radiofréquences en fonction de la fréquence de 2 GHz à 120 GHz [61]. Il est de plus en plus évident que l'exposition aux radiations induit un stress et peut entraîner des changements comportementaux et biochimiques chez les abeilles domestiques [62].
Les centrales thermiques (centrales au charbon) ont une longue histoire d’impacts sur l’environnement en raison de leurs émissions de particules, de polluants organiques et inorganiques. Les abeilles mellifères des ruchers qui se nourrissent près des centrales thermiques accumulent de grandes quantités de constituants primaires (Al/Fe) et d’oligo-éléments (Cr, Ba, Cu, Li et Ni) provenant des cendres volantes de charbon comparées aux abeilles des zones rurales [63 ]. On a étudié le déclin des populations d'abeilles mellifères à cause des pesticides, mais le rôle des polluants présents dans le sol sur la survie des abeilles n'a été examiné que récemment. En ce qui concerne le polluant du sol, le sélénium (Se), le pollen recueilli par les abeilles sur les plantes poussant dans les cendres volantes de charbon des centrales thermiques contenait 14 mg de Se par kg [64]. Dans une zone urbaine moins polluée de Pologne, les abeilles butineuses mellifères prélevées dans les ruches fixes contenaient 7,03 mg de Se par kg [65]. Il a été démontré par la suite que le sélénium en quantité excessive avait un effet négatif sur le comportement et la survie des abeilles mellifères. Les abeilles qui butinaient le nectar avaient des taux élevés de sélénium (en particulier le sélénate), elles étaient intoxiquées et leur population diminuait à cause de ce polluant présent dans le sol [66].
Les cendres volantes de charbon ont été elles-mêmes utilisées comme pesticide contre de nombreux types d’insectes [16]. Bon nombre des oligo-éléments présents dans les CVC sont très toxiques pour les insectes. Avant la mise au point de pesticides organiques/synthétiques, des produits chimiques et des éléments inorganiques tels que l'arsenic, le mercure, le cadmium et le bore étaient utilisés comme insecticides. L'arsenic, le cadmium, le mercure et le plomb n'ont aucune fonction utile dans les organismes vivants et peuvent être toxiques à n'importe quelle dose [67]. Un modèle d'insecte utilisé pour évaluer la toxicité du mercure a mis en évidence que le mercure induit un stress oxydatif chez les insectes, tout comme chez les vertébrés [68]. Le chlorure de cadmium (CdCl2), le chlorure mercurique (HgCl2) et le chlorure méthymercurique (MeHgCl) ont tous provoqué une toxicité marquée, notamment la mort cellulaire dans les cellules des Aedes albopictus (moustiques) avec MeHgCl> HgCl2> CdCl2 [69]. Nous avons démontré que la manipulation du climat à l'aide de cendres volantes de charbon pulvérisées est probablement une source mondiale de contamination au mercure dans la biosphère [18].
La contamination de l'eau dans les lacs, les rivières et autres masses d'eau par des polluants chimiques est l'une des menaces les plus importantes pour toutes les espèces sauvages, y compris les insectes. Les éléments toxiques des CVC pénètrent facilement dans l'eau où ils se concentrent dans les plantes aquatiques et les insectes. Le sélénium, l’un de ces éléments, est un oligo-élément essentiel qui devient toxique en quantités plus élevées. Le développement et la survie des insectes herbivores peuvent être affectés par des concentrations de sélénium, aussi faibles à modérées soient-elles, à travers la pollution des plantes [70]. Des niveaux élevés de cuivre, de zinc, de fer, de manganèse, de plomb, de cobalt et de cadmium ont été détectés dans des échantillons d’eau et de corps d’insectes aquatiques provenant de sites pollués [71]. Il a été démontré que ces polluants provoquent à la fois un stress oxydatif et une génotoxicité (par exemple, des cassures/dommages chromosomiques) dans les contaminations aquatiques. De petites quantités de métaux lourds peuvent même modifier les caractéristiques physicochimiques de l'eau et affecter considérablement le métabolisme des insectes [71].
Un autre facteur important contribuant à la disparition des insectes dans le monde entier est le niveau élevé de rayonnement UV-B et UV-C à ondes courtes qui a pénétré la surface de la Terre et qui est largement inavoué [72-75]. Nous avons suggéré que cette augmentation des rayonnements UV-B et UV-C mortels est en partie causée par la géo-ingénierie utilisant les CVC qui insuffle des substances chimiques appauvrissant la couche d'ozone (par exemple le chlore) dans l'atmosphère [75]. Les spectres d'action de la mutagénèse et de la létalité de la lumière solaire présentent deux maxima, à la fois dans les régions UV-B et UV-C [76]. Les insectes sont très sensibles aux changements de la lumière UV-B et les UV-B solaires ont un effet direct et indirect (par transfert végétal) important sur les arthropodes [77]. Il a été récemment démontré que les UV-B influencent et perturbent la métamorphose des insectes [78]. Le rayonnement UV-C (100-290 nm) est bien connu pour être mortel pour les insectes [79].
Le tableau 1 présente un bref aperçu des effets toxiques des composants des cendres volantes de charbon (CVC).
_____________________________________________________________
Composants primaires des cendres volantes de charbon (CVC) :
_____________________________________________________________
Silicium (Si) - Son dépôt dans les plantes crée une barrière pour l'alimentation/le sondage des insectes et la pénétration dans les tissus végétaux. Les composants contenant du silicium enlèvent/détruisent la couche cireuse des insectes provoquant une dessiccation.
_____________________________________________________________
Aluminium (Al) – Les CVC sont les principales sources d’aluminium chimiquement mobile. L’aluminium n'a pas de fonction biologique chez les insectes et est utilisé dans les insecticides (Al-phosphure). Les toxicités de l'aluminium comprennent des déformations et des changements défavorables dans le comportement/la recherche de nourriture (abeilles). Les particules anthropogéniques d’aluminosilicates des CVC « recouvrent » les insectes, y compris les abeilles.
_____________________________________________________________
Fer (Fe) - Le fer ionique est l’un des polluants atmosphériques les plus réactifs. Biologiquement, l'excès de fer provoque un stress oxydatif et une peroxydation lipidique. Les particules de pollution à la magnétite (Fe3O4) « recouvrent » les insectes et sont extrêmement sensibles aux champs électromagnétiques externes; elles peuvent interférer avec la magnéto-réception des insectes.
_____________________________________________________________
Nanoparticules (abondantes dans les CVC) - On suppose raisonnablement que les nanoparticules dans les CVC sont nuisibles aux insectes car des nanoparticules de Al, Si et Fe fabriquées chimiquement sont en cours de développement pour lutter contre les insectes.
_____________________________________________________________
Oligo-éléments dans les cendres volantes de charbon:
_____________________________________________________________
L'arsenic (As), le cadmium (Cd), le mercure (Hg) et le bore (B) ont été utilisés comme insecticides. L'arsenic, le cadmium, le mercure et le plomb (Pb) n'ont aucune fonction utile connue dans les organismes vivants et peuvent être toxiques à n'importe quelle dose.
_____________________________________________________________
Il a été démontré que le sélénium (Se) se concentre dans les plantes cultivées dans les centres volantes de charbon et s’accumule avec une toxicité chez les insectes (par exemple les abeilles) en quête de nourriture ou qui se nourrissent de ces plantes. Le sélénium en excès s'est révélé toxique pour de nombreux organismes du milieu aquatique, y compris les insectes.
_____________________________________________________________
CONCLUSION
Les cendres volantes de charbon, y compris leur utilisation dans des opérations secrètes d’ingénierie climatique (non divulguées), constituent un suspect de premier plan dans le déclin mondial des insectes. Les CVC sont une source mondiale de pollution connue pour être toxique pour les insectes et qui contaminent l'air, l'eau et le sol. En fait, nous pensons que parmi les nombreuses menaces qui pèsent sur les insectes, à savoir la perte/dégradation de l’habitat, les pesticides, les espèces étrangères et les maladies, la géo-ingénierie atmosphérique, en particulier les CVC, pourrait être la cause la plus grave de la perte catastrophique d’insectes à l’échelle mondiale. Les données précédemment publiées et mises à jour dans cette étude concordent avec le fait que les CVC sont les principales particules des pulvérisations aériennes secrètes utilisées dans la géo-ingénierie troposphérique. Les cendres volantes de charbon affectent les insectes dans les milieux aérien, terrestre et aquatique. Les cendres volantes de charbon sont impliquées dans le déclin dramatique des insectes, car ses principaux composants (aluminosilicates et fer) ainsi que de multiples oligo-éléments se trouvent dans, sur et autour des insectes prélevés dans les zones polluées du monde entier. Il est impératif d’authentifier et d'étendre ces résultats, de rechercher les « empreintes » des CVC dans les eaux pluviales, les insectes et leur environnement, dans des zones éloignées des sites industriels mais impactées par les pulvérisations de CVC. Les CVC utilisées dans la géo-ingénierie atmosphérique contribuent
probablement à l'irradiance croissante par rayonnement UV-B et UV-C qui est mortel pour les insectes.
À ce jour, aucune cause statistiquement significative n'a été identifiée pour expliquer la disparition des insectes [1-12]. Le principe de précaution, proposé comme nouvelle ligne directrice dans la prise de décision en matière d’environnement [80], comprend quatre éléments centraux: 1) prendre des mesures préventives face à l’incertitude; (2) transférer la charge de la preuve aux promoteurs d'une activité (dans ce cas, les pulvérisations aériennes de particules ); (3) explorer un large éventail d'alternatives à des actions potentiellement dangereuses; et (4) accroître la participation du public à la prise de décisions, qui, en matière de disparition à grande échelle des insectes, devrait à juste titre inclure les scientifiques. C’est dans cet esprit que nous avons révélé des causes primaires, mais non encore reconnues, du déclin catastrophique des insectes. Il est nécessaire d’exposer et de stopper la géo-ingénierie des pulvérisations atmosphériques afin d’empêcher toute nouvelle contamination de la biosphère. Une fois les pulvérisations aériennes stoppées, le retour progressif des insectes sera la meilleure preuve que les CVC pulvérisées sont en fait l’une des principales causes du déclin drastique actuel de la population et de la diversité des insectes.
CONFLITS D'INTÉRÊTS
Les auteurs ont déclaré n'avoir pas de conflits d'intérêts.
RÉFÉRENCES
1. Cox-Foster D, VanEngelsdorp D. Saving the honey bee. Scientific American. 2009;300(4):40-7.
2. Council NR. Status of pollinators in North America: National Academies Press; 2007.
3. Grixti JC, Wong LT, Cameron SA, Favret C. Decline of bumble bees (Bombus) in the North American Midwest. Biological conservation. 2009;142(1):75-84.
4. Goulson D, Lye GC, Darvill B. Decline and conservation of bumble bees. Annu Rev Entomol. 2008;53:191-208.
5. Cameron SA, Lozier JD, Strange JP, Koch JB, Cordes N, Solter LF, et al. Patterns of widespread decline in North American bumble bees. Proceedings of the National Academy of Sciences. 2011;108(2):662-7.
6. Evans JD, Saegerman C, Mullin C, Haubruge E, Nguyen BK, Frazier M, et al. Colony collapse disorder: a descriptive study. PLoS ONE. 2009;4(8):e6481.
7. Watanabe ME. Colony collapse disorder: many suspects, no smoking gun. BioScience. 2008;58(5):384-8.
8. Hallmann CA, Sorg M, Jongejans E, Siepel H, Hofland N, Schwan H, et al. More than 75 percent decline over 27 years in total flying insect biomass in protected areas. PLoS ONE. 2017;12(10):e0185809.
9. Brooks DR, Bater JE, Clark SJ, Monteith DT, Andrews C, Corbett SJ, et al. Large carabid beetle declines in a United Kingdom monitoring network increases evidence for a widespread loss in insect biodiversity. Journal of Applied Ecology. 2012;49(5):1009-19.
10. Conrad KF, Warren MS, Fox R, Parsons MS, Woiwod IP. Rapid declines of common, widespread British moths provide evidence of an insect biodiversity crisis. Biological conservation. 2006;132(3):279-91.
11. Thomas J. Monitoring change in the abundance and distribution of insects using butterflies and other indicator groups. Philosophical Transactions of the Royal Society of London B: Biological Sciences. 2005;360(1454):339-57.
12. Dirzo R, Young HS, Galetti M, Ceballos G, Isaac NJ, Collen B. Defaunation in the Anthropocene. Science. 2014;345(6195):401-6.
13. Deonarine A, Bartov G, Johnson TM, Ruhl L, Vengosh A, Hsu-Kim H. Environmental impacts of the Tennessee Valley Authority Kingston coal ash spill. 2. Effect of coal ash on methylmercury in historically contaminated river sediments. Environmental Science & Technology. 2013;47(4):2100-8.
14. Harkness JS, Sulkin B, Vengosh A. Evidence for coal ash ponds leaking in the southeastern United States. Environmental Science & Technology. 2016;50(12):6583-92.
15. Environmental Protection Agency EPA: https://www.epa.gov/coalash/coal-ash-reuse Accessed June 4, 2018.
16. Basu M, Pande M, Bhadoria PBS, Mahapatra SC. Potential fly-ash utilization in agriculture: A global review. Progress in Natural Science. 2009;19(10):1173-86.
17. Herndon JM, Whiteside M. Further evidence of coal fly ash utilization in
tropospheric geoengineering: Implications on human and environmental health. J Geog Environ Earth Sci Intn. 2017;9(1):1-8.
18. Herndon JM, Whiteside M. Contamination of the biosphere with mercury: Another potential consequence of on-going climate manipulation using aerosolized coal fly ash J Geog Environ Earth Sci Intn. 2017;13(1):1-11.
19. Herndon JM. Evidence of variable Earth-heat production, global non-anthropogenic climate change, and geoengineered global warming and polar melting. J Geog Environ Earth Sci Intn. 2017;10(1):16.
20. Shearer C, West M, Caldeira K, Davis SJ. Quantifying expert consensus against the existence of a secret large-scale atmospheric spraying program. Environ Res Lett. 2016;11(8):p. 084011.
21. Moreno N, Querol X, Andrés JM, Stanton K, Towler M, Nugteren H, et al. Physico-chemical characteristics of European pulverized coal combustion fly ashes. Fuel. 2005;84:1351-63.
22. Herndon JM. Aluminum poisoning of humanity and Earth's biota by clandestine geoengineering activity: implications for India. Curr Sci. 2015;108(12):2173-7.
23. Chen Y, Shah N, Huggins FE, Huffman GP. Transmission electron microscopy investigation of ultrafine coal fly ash particles. Environ Science and Technogy. 2005;39(4):1144-51.
24. Thomas W. Chemtrails Confirmed. Carson City, Nevada (USA): Bridger House Publishers; 2004.
25. Fisher GL. Biomedically relevant chemical and physical properties of coal combustion products. Environ Health Persp. 1983;47:189-99.
26. Alstad D, Edmunds Jr G, Weinstein L. Effects of air pollutants on insect populations. Annual Review of Entomology. 1982;27(1):369-84.
27. Forouzanfar MH, Alexander L, Anderson HR, Bachman VF, Biryukov S, Brauer M, et al. Global, regional, and national comparative risk assessment of 79 behavioural, environmental and occupational, and metabolic risks or clusters of risks in 188 countries, 1990–2013: a systematic analysis for the Global Burden of Disease Study 2013. The lancet. 2015;386(10010):2287-323.
28. State of Global Air https://www.stateofglobalair.org Accessed June 4, 2018.
29. Jensen P, Trumble JT. Ecological consequences of bioavailability of metals and metalloids in insects. Recent Res Dev Entomol. 2003;42:1-17.
30. Butler CD, Trumble JT. Effects of pollutants on bottom-up and top-down processes in insect–plant interactions. Environmental Pollution. 2008;156(1):1-10.
31. Trumble JT, Vickerman DB. Pollution and Terrestrial Arthropods. Encyclopedia of Entomology: Springer; 2004. p. 1787-9.
32. Brake S, Jensen R, Mattox J. Effects of coal fly ash amended soils on trace element uptake in plants. Environmental Geology. 2004;45(5):680-9.
33. Calatayud P, Njuguna E, Juma G. Silica in Insect-Plant Interactions. Entomol Ornithol Herpetol. 2016;5:e125.
34. Mucha-Pelzer T, Debnath N, Goswami A, Mewis I. Comparison of different silicas of natural origin as possible insecticides. Communications in agricultural and applied biological sciences. 2008;73(3):621-8.
35. Vuori KM. Acid‐induced acute toxicity of aluminium to three species of filter feeding caddis larvae (Trichoptera, Arctopsychidae and Hydropsychidae). Freshwater Biology. 1996;35(1):179-88.
36. Kijak E, Rosato E, Knapczyk K, Pyza E. Drosophila melanogaster as a model system of aluminum toxicity and aging. Insect science. 2014;21(2):189-202.
37. Chicas-Mosier AM, Cooper BA, Melendez AM, Pérez M, Oskay D, Abramson CI. The effects of ingested aqueous aluminum on floral fidelity and foraging strategy in honey bees (Apis mellifera). Ecotoxicology and Environmental Safety. 2017;143:80-6.
38. Nichol H, Law JH, Winzerling JJ. Iron metabolism in insects. Annual Review of Entomology. 2002;47(1):535-59.
39. Ghio AJ, Cohen MD. Disruption of iron homeostasis as a mechanism of biologic effect by ambient air pollution particles. Inhalation Toxicology. 2005;17(13):709-16.
40. Sohal R, Allen R, Farmer K, Newton R. Iron induces oxidative stress and may alter the rate of aging in the housefly, Musca domestica. Mechanisms of ageing and development. 1985;32(1):33-8.
41. Ferrero A, Torreblanca A, Garcerá MD. Assessment of the effects of orally administered ferrous sulfate on Oncopeltus fasciatus (Heteroptera: Lygaeidae). Environ Sci Pollut Res. 2017;24(9):8551-61.
42. Exley C, Rotheray E, Goulson D. Bumblebee pupae contain high levels of aluminum. PLoS ONE. 2015;10(6):e0127665.
43. van der Steen JJ, de Kraker J, Grotenhuis T. Spatial and temporal variation of metal concentrations in adult honey bees (Apis mellifera L.). Environmental Monitoring and Assessment. 2012;184(7):4119-26.
44. Zhelyazkova I. Honey bees–bioindicators for environmental quality. Bulg J Agric Sci. 2012;18(3):435-42.
45. Altunatmaz SS, Tarhan D, Aksu F, Barutcu UB, Or ME. Mineral element and heavy metal (cadmium, lead and arsenic) levels of bee pollen in Turkey. Food Science and Technology (Campinas). 2017(AHEAD):0-.
46. Kostić AŽ, Pešić MB, Mosić MD, Dojčinović BP, Natić MM, Trifković JĐ. Mineral content of bee pollen from Serbia/Sadržaj minerala u uzorcima pčelinjega peluda iz Srbije. Archives of Industrial Hygiene and Toxicology. 2015;66(4):251-8.
47. Sattler JAG, De-Melo AAM, Nascimento KS, Mancini-Filho J, Sattler A, al. e. Essential minerals and inorganic contaminants (barium, cadmium, lithium, lead and vanadium) in dried bee pollen produced in Rio Grande do Sul State, Brazil. Food Science and Technology (Campinas). 2016;36(3):505-9.
48. Azam I, Afsheen S, Zia A, Javed M, Saeed R, Sarwar MK, et al. Evaluating insects as bioindicators of heavy metal contamination and accumulation near industrial area of Gujrat, Pakistan. BioMed Research International. 2015;2015.
49. Karadjova I, Markova E. Metal accumulation in insects (Orthoptera, Acrididae) near a copper smelter and copper-flotation factory (Pirdop, Bulgaria). Biotechnology & Biotechnological Equipment. 2009;23(sup1):204-7.
50. Devkota B, Schmidt G. Accumulation of heavy metals in food plants and grasshoppers from the Taigetos Mountains, Greece. Agriculture, ecosystems & environment. 2000;78(1):85-91.
51. Negri I, Mavris C, Di Prisco G, Caprio E, Pellecchia M. Honey bees (Apis mellifera, L.) as active samplers of airborne particulate matter. PLoS ONE. 2015;10(7):e0132491.
52. Kitherian S. Nano and Bio-nanoparticles for Insect Control. Res J Nanosci Nanotechnol. 2017.
53. Buteler M, Sofie S, Weaver D, Driscoll D, Muretta J, Stadler T. Development of nanoalumina dust as insecticide against Sitophilus oryzae and Rhyzopertha dominica. International journal of pest management. 2015;61(1):80-9.
54. Murugan K, Dinesh D, Nataraj D, Subramaniam J, Amuthavalli P, Madhavan J, et al. Iron and iron oxide nanoparticles are highly toxic to Culex quinquefasciatus with little non-target effects on larvivorous fishes. Environ Sci Pollut Res. 2018;25(11):10504-14.
55. Maher BA, Ahmed IAM, Karloukovski V, MacLauren DA, Foulds PG, et al. Magnetite pollution nanoparticles in the human brain. Proc Nat Acad Sci. 2016;113(39):10797-801.
56. Acosta-Avalos DL, Wajnberg E, Oliveira PS, Leal I, Farina M, Esquivel DM. Isolation of magnetic nanoparticles from Pachycondyla marginata ants. Journal of Experimental Biology. 1999;202(19):2687-92.
57. Liang C-H, Chuang C-L, Jiang J-A, Yang E-C. Magnetic sensing through the abdomen of the honey bee. Scientific Reports. 2016;6:23657.
58. Maher BA. Magnetite biomineralization in termites. Proceedings of the Royal Society of London B: Biological Sciences. 1998;265(1397):733-7.
59. Petrovský E, Zbořil R, Grygar TM, Kotlík B, Novák J, Kapička A, et al. Magnetic particles in atmospheric particulate matter collected at sites with different level of air pollution. Studia Geophysica et Geodaetica. 2013;57(4):755-70.
60. Kirschvink JL. Microwave absorption by magnetite: A possible mechanism for coupling non-thermal levels of radiation to biological systems. Bioelectromag. 1996;17:187-94.
61. Thielens A, Bell D, Mortimore DB, Greco MK, Martens L, Joseph W. Exposure of Insects to Radio-Frequency Electromagnetic Fields from 2 to 120 GHz. Scientific Reports. 2018;8(1):3924.
62. Kumar NR, Sangwan S, Badotra P. Exposure to cell phone radiations produces biochemical changes in worker honey bees. Toxicology international. 2011;18(1):70.
63. Zarić N, Ilijević K, Stanisavljević L, Gržetić I. Metal concentrations around thermal power plants, rural and urban areas using honey bees (Apis mellifera L.) as bioindicators. International journal of environmental science and technology. 2016;13(2):413-22.
64. De Jong D, Morse RA, Gutenmann WH, Lisk DJ. Selenium in pollen gathered by bees foraging on fly ash-grown plants. Bulletin of environmental contamination and toxicology. 1977;18(4):442-4.
65. Roman A. Levels of Copper, Selenium, Lead, and Cadmium in Forager Bees. Polish journal of environmental studies. 2010;19(3).
66. Hladun KR, Smith BH, Mustard JA, Morton RR, Trumble JT. Selenium toxicity to honey bee (Apis mellifera L.) pollinators: effects on behaviors and survival. PLoS ONE. 2012;7(4):e34137.
67. Tchounwou PB, Yedjou CG, Patlolla AK, Sutton DJ. Heavy metal toxicity and the environment. EXS. 2012;101:133-64.
68. Zaman K, MacGill R, Johnson J, Ahmad S, Pardini R. An insect model for assessing mercury toxicity: effect of mercury on antioxidant enzyme activities of the housefly (Musca domestica) and the cabbage looper moth (Trichoplusia ni). Archives of Environmental Contamination and Toxicology. 1994;26(1):114-8.
69. Braeckman B, Raes H, Van Hoye D. Heavy-metal toxicity in an insect cell line. Effects of cadmium chloride, mercuric chloride and methylmercuric chloride on cell viability and proliferation in Aedes albopictus cells. Cell biology and toxicology. 1997;13(6):389-97.
70. Trumble JT, Kund G, White K. Influence of form and quantity of selenium on the development and survival of an insect herbivore. Environmental Pollution. 1998;101(2):175-82.
71. Shonouda M, El-Samad L, Mokhamer H, Toto N. Use of oxidative streess and genotoxic biomarkers of aquatic beetles Anacaena globulus (Coleoptera: Hydrophilidae) as biomonitors of water pollution. J Entomol. 2016;13:122-31.
72. Cabrol NA, Feister U, Häder D-P, Piazena H, Grin EA, Klein A. Record solar UV irradiance in the tropical Andes. Frontiers in Environmental Science. 2014;2(19).
73. Córdoba C, Munoz J, Cachorro V, de Carcer IA, Cussó F, Jaque F. The detection of solar ultraviolet-C radiation using KCl:Eu2+ thermoluminescence dosemeters. Journal of Physics D: Applied Physics. 1997;30(21):3024.
74. D'Antoni H, Rothschild L, Schultz C, Burgess S, Skiles J. Extreme environments in the forests of Ushuaia, Argentina. Geophysical Research Letters. 2007;34(22).
75. Herndon JM, Hoisington RD, Whiteside M. Deadly ultraviolet UV-C and UV-B penetration to Earth’s surface: Human and environmental health implications. J Geog Environ Earth Sci Intn. 2018;14(2):1-11.
76. Ravanat J-L, Douki T, Cadet J. Direct and indirect effects of UV radiation on DNA and its components. Journal of Photochemistry and Photobiology B: Biology. 2001;63(1):88-102.
77. Ballare CL, Caldwell MM, Flint SD, Robinson SA, Bornman JF. Effects of solar ultraviolet radiation on terrestrial ecosystems. Patterns, mechanisms, and interactions with climate change. Photochemical & Photobiological Sciences. 2011;10(2):226-41.
78. Sang W, Yu L, He L, Ma W-H, Zhu Z-H, Zhu F, et al. UVB radiation delays Tribolium castaneum metamorphosis by influencing ecdysteroid metabolism. PLoS ONE. 2016;11(3):e0151831.
79. Hori M, Shibuya K, Sato M, Saito Y. Lethal effects of short-wavelength visible light on insects. Scientific Reports. 2014;4:7383.
80. Kriebel D, Tickner J, Epstein P, Lemons J, Levins R, Loechler EL, et al. The precautionary principle in environmental science Environ Healt Perspec. 2001;109(9):871-6.
Article en anglais : http://www.nuclearplanet.com/whin.pdf
© 2018 Whiteside and Herndon; Ceci est un article Open Access distribué selon les termes de la Licence Creative Commons Attribution (http://creativecommons.org/licenses/by/4.0
), qui permet une utilisation, une distribution et une reproduction illimitées sur tout support, à condition que l’œuvre originale soit correctement citée.
Historique de l'examen par les pairs:
L'historique de l'évaluation par les pairs pour cet article peut être consulté ici: http://www.sciencedomain.org/review-history/25994
Whiteside and Herndon; AJOB, 6(4): 1-13, 2018; Article no.AJOB.43268
email : mherndon@san.rr.com

/image%2F1416990%2F20220903%2Fob_da6312_logo-2022-2.jpg)
/https%3A%2F%2Fi.ytimg.com%2Fvi%2FqXo8_Z2pyUc%2Fhqdefault.jpg)
/https%3A%2F%2Fthumbnails.odycdn.com%2Fcard%2Fs%3A1280%3A720%2Fquality%3A85%2Fplain%2Fhttps%3A%2F%2Fthumbs.odycdn.com%2Fb818718e78a0661c8f9ab372e925574e.webp)
/https%3A%2F%2Fthumbnails.odycdn.com%2Fcard%2Fs%3A1280%3A720%2Fquality%3A85%2Fplain%2Fhttps%3A%2F%2Fthumbnails.lbry.com%2FWukzKDMYkbY)
/https%3A%2F%2Fthumbnails.odycdn.com%2Fcard%2Fs%3A1280%3A720%2Fquality%3A85%2Fplain%2Fhttps%3A%2F%2Fthumbs.odycdn.com%2Fecfb0803a226fc6fb5ab295ff044b3fe.webp)
/https%3A%2F%2Fi.ytimg.com%2Fvi%2F1NUZD5B_f9o%2Fhqdefault.jpg)
/https%3A%2F%2Fthumbnails.odycdn.com%2Fcard%2Fs%3A1280%3A720%2Fquality%3A85%2Fplain%2Fhttps%3A%2F%2Fthumbs.odycdn.com%2F55fb35cc10dc0cd8b92e731d6edf5f80.webp)
/https%3A%2F%2Fthumbnails.odycdn.com%2Fcard%2Fs%3A1280%3A720%2Fquality%3A85%2Fplain%2Fhttps%3A%2F%2Fthumbnails.lbry.com%2FjPpAxZZ2Y3Y)
/https%3A%2F%2Fi.ytimg.com%2Fvi%2F4-DYc0Rq8b4%2Fhqdefault.jpg)
/https%3A%2F%2Fthumbnails.odycdn.com%2Fcard%2Fs%3A1280%3A720%2Fquality%3A85%2Fplain%2Fhttps%3A%2F%2Fthumbs.odycdn.com%2F745fe0672451ff7832e2df05f38d8db2.webp)
/https%3A%2F%2Fthumbnails.odycdn.com%2Fcard%2Fs%3A1280%3A720%2Fquality%3A85%2Fplain%2Fhttps%3A%2F%2Fthumbs.odycdn.com%2Fc6eea8345ca09717ba0035dd72108e03.webp)


/https%3A%2F%2Fi.ytimg.com%2Fvi%2FqXo8_Z2pyUc%2Fhqdefault.jpg)
/https%3A%2F%2Fthumbnails.odycdn.com%2Fcard%2Fs%3A1280%3A720%2Fquality%3A85%2Fplain%2Fhttps%3A%2F%2Fthumbs.odycdn.com%2F198d59c6cf8d4e4ce97b3d6806380ff4.webp)
/https%3A%2F%2Fthumbnails.odycdn.com%2Fcard%2Fs%3A1280%3A720%2Fquality%3A85%2Fplain%2Fhttps%3A%2F%2Fthumbs.odycdn.com%2F645fdb7e9c58c9461f6e7edfea1d1aae.webp)
/https%3A%2F%2Fthumbnails.odycdn.com%2Fcard%2Fs%3A1280%3A720%2Fquality%3A85%2Fplain%2Fhttps%3A%2F%2Fthumbs.odycdn.com%2F075d01b9b9df38378aafc1cc06924818.webp)